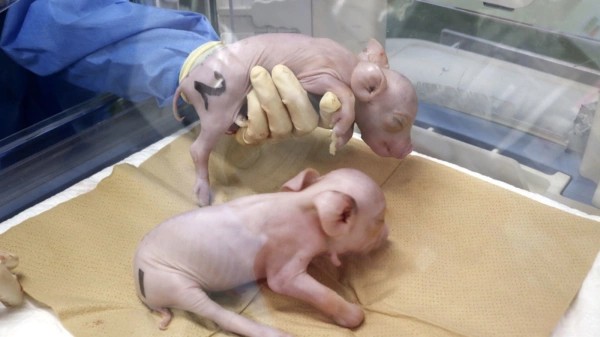
Возможно, через несколько десятков лет именно для вас вырастят подобную свинью, чтобы продлить жизнь
Человеческий организм было бы неправильно рассматривать исключительно с механистической точки зрения. Тем не менее люди, как и сложные механизмы, ломаются, требуют замены изношенных и отказавших частей.
Мы достаточно много вкладываем в прикладные научные исследования в области биомедицины. Рассмотрю только один аспект: есть огромный запрос на донорские органы, и это порождает большой рынок альтернатив.
Сейчас донорство органов — это всегда радостное событие для одних, но печальное — для других. Да, есть замечательные люди, которые при жизни согласились спасти других, если с ними самими что-то случится. Но сегодня я буду говорить об альтернативе, которая стала одним из наиболее перспективных направлений в продлении жизни и трансплантологии:
- Что общего у человека и партии жёстких дисков с бракованными деталями.
- Зачем мы сворачиваем белки в комок.
- Как студенты соглашаются перелить себе кровь овцы, а потом пропивают гонорар.
- Почему нельзя просто взять и сшить человека и свинью.
- Как выключить ненужное и включить нужное в ГМО-свиньях.
- Почему почку пересаживали мёртвому человеку.
- Как случайно не создать очередной ВИЧ.
Человек как механизм
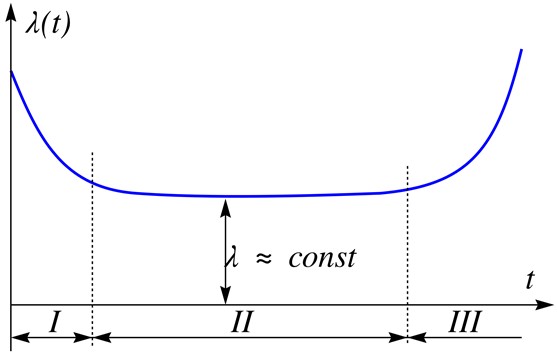
Зависимость интенсивности отказов механизмов от времени. Очень похоже на то, что происходит с рисками для человека.
I — период приработки и отказов некачественных изделий. В контексте человека сюда было бы корректнее включить не только младенческую смертность в наиболее уязвимый период, но и естественную «отбраковку» эмбрионов со скрытыми генетическими и фенотипическими дефектами. Нередко женщина может даже не догадываться о самопроизвольном прерывании беременности на самых ранних сроках. Неудачный митоз на самых первых этапах, фатальные мутации или дефекты гамет приводят к тому, что процесс аварийно завершается, чтобы не тратить огромных сил и здоровья будущей матери на вынашивание.
II — период нормальной эксплуатации. Как и в случае механизмов, после прохождения более рискованного раннего детского периода интенсивность «поломок» примерно равномерна в течение всего молодого возраста. Фатальные врождённые патологии уже привели к выбыванию из статистики, а более мелкие дефекты пока существенно не влияют на здоровье.
III — период старения. Одинаков для механизмов и живых существ. После определённого возраста всё интенсивнее становится влияние от накопленных мутаций, микроповреждений, замены нормальной ткани на соединительную в зонах хронического воспаления и травм. В результате риски болезни и смерти в этот период растут с зависимостью, близкой к экспоненте.
Все мы хотели бы по возможности не болеть и как можно дольше удерживаться в том самом периоде, когда можно бодрым и активным вставать на учёбу после бессонной ночи в ночном клубе, а самые тяжёлые проблемы со здоровьем выглядят как гастрит из-за Helicobacter pylori и странноватого подхода к кулинарии у новой девушки. Если сильно упрощать, то основные задачи медицины на этом этапе сводятся к лечению травм, возникших в результате особенно красивых прыжков на скейтборде перед симпатичной девушкой, душеспасительным беседам о вреде курения и снижению рисков тяжёлых инфекционных заболеваний.
Со временем все мы достигаем момента, когда естественные механизмы регенерации и поддержания равновесия начинают постепенно выходить из строя. И вот
на этом этапе жизни человека сфокусированы основные усилия исследователей из различных отраслей медицины: фармакологии, патфизиологии, гериатрии, трансплантологии и множества других. Открытия в этих областях потенциально раздвигают для нас границы активной молодости и улучшают качество жизни в пожилом возрасте.
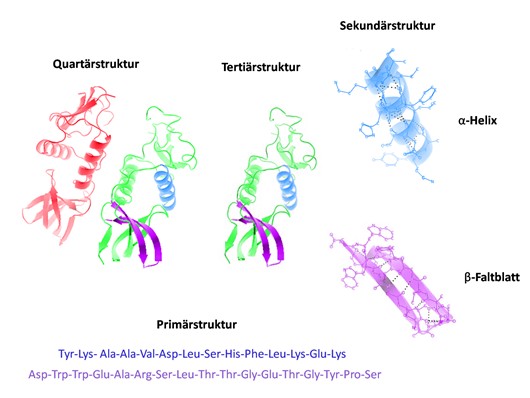
Первичная, вторичная и другие пространственные структуры белка более высоких порядков
Чаще всего такие разработки происходят на стыке нескольких дисциплин. Так, например, обученная нейросеть AlphaFold от Google DeepMind позволила многократно повысить точность в задачах фолдинга белков. Как многие помнят, в базовом варианте белок представляет собой цепочку аминокислот, собранных в порядке, который был продиктован рибосомам при сборке с помощью нуклеиновых кислот. Основная проблема в том, что реальная структура белка многократно сложнее, чем просто длинная линейная цепочка из аминокислот. Любому ферменту, чтобы выполнять свои функции, после сборки на рибосомах надо пройти постпроцессинг, где его заботливо свернут в комок сложной формы. Этот процесс и называют фолдингом — складыванием. Обычно эту функцию выполняют белки-шапероны. Многие из них относятся к белкам теплового шока, активируясь и причёсывая растрёпанные протеиновые молекулы в случае нарушения их структуры.
Разработки DeepMind позволили сделать то, что ранее требовало колоссальных расчётов — предсказание третичной и четвертичной структур белка по его первичной цепочке. Собирать бусы в нужном порядке мы умеем, а предугадывать их трёхмерную структуру пока только учимся. Это критически важно для медицины, так как именно финальное строение синтезированных пептидов и белков определяет, смогут ли они подойти к рецептору клетки или сработают как катализатор какой-то сложной химической реакции. Теперь, если мы знаем последовательность ДНК, описывающую какой-то естественный клеточный рецептор, мы можем гораздо быстрее подобрать такую последовательность аминокислот в искусственном пептиде, которая скрутится в активирующий «ключ».
Все эти разработки сильно помогают нам продвинуться в том, чтобы чинить накопленные повреждения организма на микроуровне. Проблемы начинаются в тот момент, когда чинить нужно в более крупных масштабах.
Нам нужны запчасти

Тысячи пациентов нуждаются не только в донорских органах, но также в крови и её компонентах
Проблема донорских органов в том, что их всегда меньше, чем нужно. А ещё их получение всегда связано с кучей этических проблем. Если с донациями крови всё ещё как-то более или менее прозрачно, так как донору это не грозит какими-то существенными проблемами со здоровьем, то с парными органами всё уже непросто. Отдать одну почку вполне можно, но сам при этом останешься без резерва, и новая не отрастёт. Донорство сердца, роговицы и других органов вообще подразумевает, что эти компоненты организму уже не понадобятся.
Традиционное донорство органов, хоть и спасает тысячи жизней, нередко оказывается чем-то вроде весьма мрачной лотереи: ждать нужный орган, бороться с этическими дилеммами и снова ждать чьей-то смерти. И вот тут появляется та технология, которая потенциально сможет всё изменить: это ксенотрансплантация. Ксенотрансплантация — это пересадка органов, тканей или клеток от организма одного биологического вида другому, например, от животных — к человеку.
Первая задокументированная ксенотрансплантация была проведена 23 ноября 1667 года Ричардом Лоуэром. К тому моменту Лоуэр уже успешно осуществил переливание крови с полным замещением всего объёма от собаки к собаке. Собака-реципиент выжила. В качестве подопытного для ксенотрансплантации он использовал крайне бедного 22-летнего студента богословлия Артура Кога. Денег у того не было, его психическое состояние тоже вызывало вопросы. Участники эксперимента надеялись, что переливание крови от «кроткой овечки» поможет охладить его вспыльчивый нрав и приведёт в норму психическое состояние. Во время эксперимента пациенту ввели 12 унций (354 мл) овечьей крови. Пациент не только выжил, но и уверял всех, что чувствует себя отлично. Спустя месяц он согласился на вторую процедуру в присутствии большого числа свидетелей и тоже выжил. Деньги, полученные в качестве гонорара за эксперименты, он благополучно пропил.
Подобный перенос тканей, органов или компонентов крови между видами чаще всего заканчивается фатально либо для органа, либо для всего реципиента целиком.
Внутривидовая пересадка — это как обмен автозапчастями между разными моделями одной автомобильной линейки, где хоть и не всё идеально, но детали всё же совместимы. Попытки же засунуть помпу от посудомойки вместо бензонасоса, скорее всего, будут фатальны.
Если вы возьмёте и просто пересадите почку от свиньи к человеку, то она в течение нескольких минут превратится в нерабочий кусок биомассы, забитый тромбами. Следом погибнет и сам реципиент, если её не убрать. Основная причина кроется в поверхностных мембранных белках. Наша иммунная система очень внимательно осматривает все возможные клетки, до которых может добраться. Иногда попадается клетка, которая синтезом интерферонов пытается привлечь к себе внимание и сообщить о заражении вирусом. Вирусные белки на поверхности такой клетки очень быстро вызывают ответ в виде живительной инъекции белков-перфоринов со стороны иммунокомпетентных клеток. Иногда попадаются сломанные клетки, которые решили, что теперь они будут активно размножаться безо всяких ограничений. Зарождающийся рак организм уничтожает точно так же быстро и агрессивно. Ну а иногда эти мембраны радикально отличаются из-за того, что это вообще ткани другого вида. Такое бывает, например, при заражении паразитарными гельминтами.
В любом случае иммунная система старается как можно быстрее локализовать и убить всё, что не похоже на нормальные ткани. Капилляры экстренно перекрываются и забиваются тромбами, чтобы перекрыть доступ к кислороду, в ход идут перфорины, мембранно-атакующий комплекс и другие способы убить и поглотить всё, что может представлять опасность. В случае тканей обычных свиней ключевым маркером чужеродности являются мембранные эпитопы альфа-1,3-галактозы (Galalpha1,3Galbeta1,4GlcNAc-R). У человека, как и у других приматов, сломан фермент альфа-1,3-галактозилтрансфераза, который эти эпитопы создаёт. Наши клетки, соответственно, их не имеют. Если иммунная система замечает их на поверхности клеток, то начинается немедленная агрессивная реакция отторжения.
Решением этой проблемы стали генно-инженерные поросята, которым этот ген сломали точно так же, как и приматам. Такое точечное выключение одного или нескольких генов называют нокаутом. Почему именно свиньям? Этот вид животных — крайне привлекательный вариант для трансплантологии из-за очень большого сходства в размерах и структуре внутренних органов.
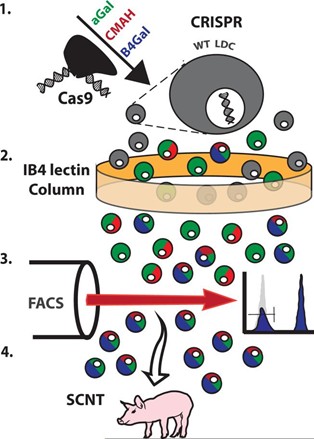
Клетки печени, которым сломали ещё несколько генов, стали менее заметны для иммунной системы приматов
Проблема в том, что выключенные мембранные эпитопы существенно замедлили, но не остановили процесс отторжения. Следующим витком в доработке стало выключение генов GGTA1/CMAH/β4GalNT2, которые отвечали за другие поверхностные антигены в тканях животного. Гипотезы проверяли не на целой свинье, а на отдельной популяции клеток печени, которые доработали уже ставшим классическим методом CRISPR-Cas9.
В 2018 году осуществили новую итерацию доработок и пошли ещё дальше, заставив клетки свиньи не только отключить синтез того, что не нужно, но и добавить специфичные для приматов антигены, которых нет у свиней. Удалось получить свинью, на клеточных мембранах которой синтезировался человеческий поверхностный гликопротеин CD47. Пересаженное сердце от такой свиньи-донора проработало в течение всего срока эксперимента. Три бабуина жили с ним три месяца, а ещё двое — полгода. Существенных патологий за этот срок не возникло, что дало надежду на преодоление реакции немедленного отторжения.
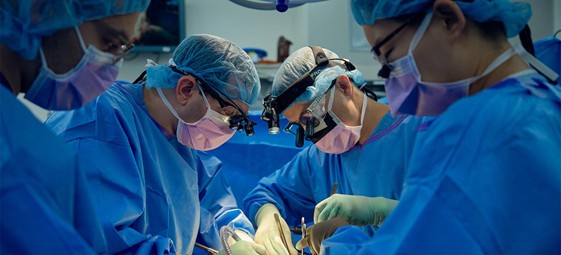
Команда хирургов NYU Langone Transplant Institute выполняет пересадку почки генетически модифицированной свиньи человеку
В 2023 году был успешно завершён уже длительный эксперимент с трансплантацией почки от генно-модифицированной свиньи к человеку. В силу этических соображений для подобного эксперимента был выбран уже мёртвый человек. Точнее, организм формально функционировал, но ранее врачи констатировали смерть головного мозга у 58-летнего пациента. С согласия родных он был введён в эксперимент и поддерживался в жизнеспособном состоянии в течение 61 суток на искусственной вентиляции лёгких. Предыдущие ксенотрансплантации до этого завершались немедленным отторжением.
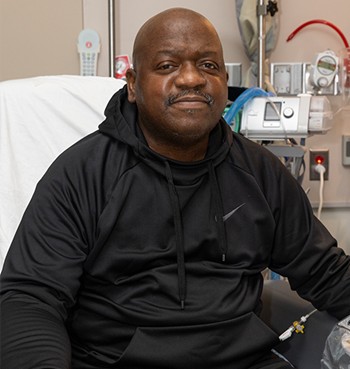
Ричард Слейман — один из пациентов с ксенотрансплантатом
В мае 2024 года была проведена трансплантация уже живому реципиенту — Ричарду Слейману. Ранее, в 2018 году, пациент получил человеческую донорскую почку, но в 2023-м она начала отказывать. Также у 63-летнего пациента начало отказывать сердце, и появился целый ряд сопутствующих серьёзных осложнений. Тем не менее он дал согласие на трансплантацию. Но спустя два месяца после операции он скончался от причин, не связанных непосредственно с пересаженной почкой.
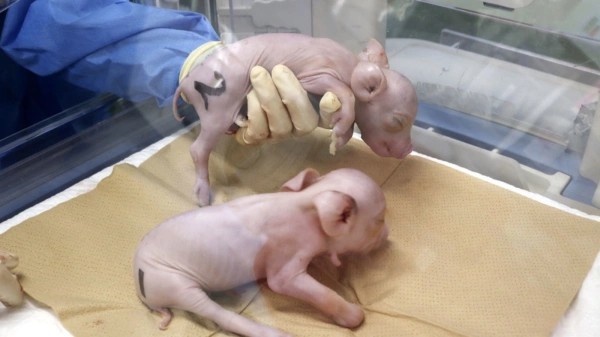
Первые клонированные поросята, модифицированные для ксенотрансплантации
Следующий шаг в этой области ожидается от японского стартапа PorMedTec.
В сентябре PorMedTec получила от американской биомедицинской компании eGenesis редактированные свиные клетки. Гены животного изменили с целью снизить риск отторжения донорских органов со стороны реципиента. Затем японский стартап перенёс ядра данных клеток в яйцеклетки, которые были имплантированы в матку суррогатной свиньи-матери. Трое поросят родились посредством кесарева сечения.
После того как специалисты убедятся в нормальном развитии молодняка, его будут использовать для дальнейших экспериментов по межвидовой трансплантации органов. Поросята станут донорами для испытаний на подопытных приматах.
Ранее свиная почка из этой линии модифицированных свиней от eGenesis успешно функционировала у примата в течение двух лет.
Не всё так просто
Да, сейчас свиньи — наиболее перспективный источник этичных донорских органов. Вместо тоскливой лотереи и ожидания очередного мотоциклиста, чьи сердце и почки смогут спасти жизнь других пациентов, можно будет ограничиться специальным стадом клонированных медицинских свиней, которые пожертвуют свои внутренние органы нуждающимся людям.
К сожалению, нельзя просто вот так взять и перенести результаты из пробирки с одиночными ГМО-клетками на человека. Опыты с бабуинами и одиночные эксперименты — тоже нельзя. Увы, но даже при идеальных условиях и пересадке от человека к человеку трансплантаты не всегда идеально приживаются и служат в среднем не более 10–15 лет. В случае ксенотрансплантации проблем поначалу будет больше, а риски — существенно выше.
Плюс есть и скрытые неочевидные риски вроде случайного создания очередного ВИЧ. Дело в том, что у свиней есть ретровирусы PERVs (porcine endogenous retroviruses). Это то самое крайне неприятное семейство, к которому относится вирус иммунодефицита человека и обезьян. В отличие от африканской чумы свиней, гриппа и множества других вирусов вы не можете просто взять и построить стерильный бункер, куда гарантированно не занесут инфекцию. Тут вся проблема в том, что это семейство вирусов встраивается непосредственно в ДНК клетки хозяина и дальше может передаваться из поколения в поколение в виде временно неактивного провируса.
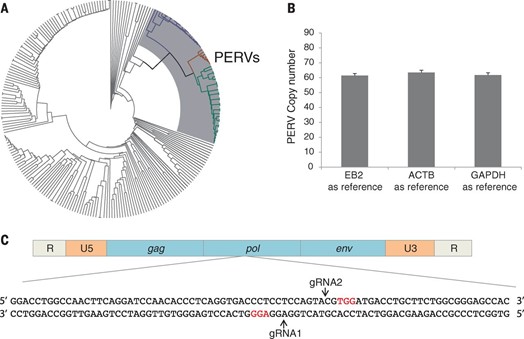
Инструментарий CRISPR-Cas9 был настроен на поиск и вырезание фрагмента pol-гена ретровирусов. Без него они не смогут размножаться.
Гарантированно извлечь из большого генома все возможные фрагменты крайне сложно, хотя и были проведены исследования, позволившие вырезать значительную часть вирусной ДНК из генома с помощью CRISPR-Cas9.
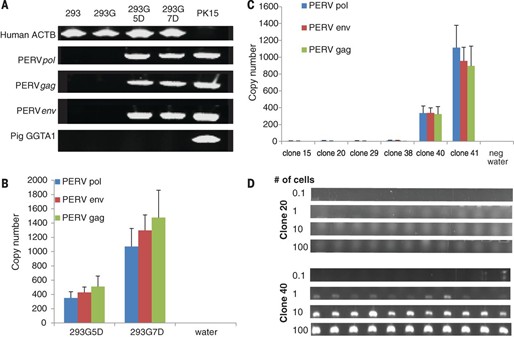
Оценка степени деактивации pol-гена в линиях человеческих клеток после контакта со свиными
Результаты, с одной стороны, многообещающие, а с другой — даже достигнутое тысячекратное падение числа копий вирусной ДНК не даёт гарантированного результата. Так что двигаться будем продуманно, медленно и осторожно, чтобы не получить ещё более сложную проблему вместо решения старых.
Что дальше?
Мы всё-таки смотрим в будущее с надеждой. Может, и не сразу, но мы сможем решить множество фундаментальных проблем, которые ограничивают наш срок жизни и возможности продления активной молодости. Это ускоренная нейросетевая разработка сложных пептидов и ручное управление отдельными рецепторами, разработки в области трансплантологии и переписывание ДНК животных-доноров, а затем — и коррекция собственных генетических дефектов.
Ксенотрансплантация станет рутинной процедурой, а для каждого пациента смогут выращивать «под заказ» его персональную свинью, которая поможет заменить отказавший орган. Да, это будет неизмеримо сложнее, чем просто замена разбитого экрана на сломанном телефоне, но миллионы людей получат второй шанс. А мы просто немного подождём. Будущее — уже где-то среди нас.
Автор: maxim_tsar